CFR 21 Part 11 oder die Electronic Records and Signatures Rule der FDA ist eine der wichtigsten Vorschriften für Unternehmen in der Life-Science-Branche. Die Verordnung legt spezifische Anforderungen für Unternehmen fest, die bei ihren Compliance-Bemühungen elektronische Aufzeichnungen und Signaturen verwenden. Dieser Standard ist für jeden, der digitale Systeme zur Verwaltung von Daten im Zusammenhang mit von der FDA regulierten Produkten verwendet, von wesentlicher Bedeutung. In diesem Blogbeitrag geben wir einen Überblick über CFR 21 Part 11, einschließlich einer Definition der Schlüsselbegriffe, Compliance-Tipps und Informationen zu verfügbaren Tools und Zertifizierungen.
Lassen Sie uns zunächst verstehen, was CFR ist...
CFR ist der Code of Federal Regulations. CFR 21 Teil 11 wurde 1997 veröffentlicht und trat im August desselben Jahres in Kraft. CFR Teil 11 gilt für alle elektronischen Aufzeichnungen und Signaturen, die unter der Zuständigkeit der FDA erstellt, geändert, verwaltet, archiviert, abgerufen oder übertragen werden. Dazu gehören Aufzeichnungen wie Laborergebnisse, Prüfprotokolle und Software-Quellcode-Listen. Es legt die Kriterien fest, nach denen elektronische Aufzeichnungen und Signaturen als vertrauenswürdig, zuverlässig und im Allgemeinen den Papieraufzeichnungen gleichwertig gelten.
Was ist CFR 21 Teil 11?
CFR 21 Teil 11, oft einfach als Teil 11 bezeichnet, ist eine von der US-amerikanischen Food and Drug Administration (FDA) herausgegebene Verordnung, die die Kriterien für elektronische Aufzeichnungen und elektronische Signaturen im Kontext der Pharma-, Biotechnologie- und Medizingeräteindustrie festlegt . Der offizielle Titel lautet „Electronic Records; Elektronische Signaturen“ und ist Teil von Titel 21 des Code of Federal Regulations (CFR), der FDA-Vorschriften enthält.
Hier sind einige wichtige Punkte zu CFR 21 Teil 11:
- Geltungsbereich: Teil 11 gilt für Aufzeichnungen, die gemäß den FDA-Vorschriften aufbewahrt werden müssen und in elektronischer Form vorliegen, sowie für elektronische Signaturen, die zum Signieren solcher Aufzeichnungen verwendet werden.
- Zweck: Die Verordnung wurde eingeführt, um die Sicherheit, Integrität und Zuverlässigkeit elektronischer Aufzeichnungen und Signaturen in von der FDA regulierten Branchen zu gewährleisten. Es trägt dazu bei, die Datengenauigkeit aufrechtzuerhalten und Betrug zu verhindern.
- Voraussetzungen: : Teil 11 beschreibt spezifische Anforderungen für elektronische Aufzeichnungen, wie z. B. Zugriffskontrollen, Datensicherheit, Prüfpfade und die Verwendung digitaler Signaturen. Außerdem werden Kriterien für elektronische Signaturen festgelegt, darunter Authentifizierung und Nichtabstreitbarkeit.
- Anwendbarkeit: Teil 11 ist in erster Linie für Branchen relevant, in denen elektronische Aufzeichnungen und Signaturen eine entscheidende Rolle bei der Einhaltung gesetzlicher Vorschriften spielen, einschließlich der pharmazeutischen Herstellung, klinischen Studien und der Verwaltung von Labordaten.
- Compliance: Unternehmen, die den FDA-Vorschriften unterliegen, müssen die Anforderungen von Teil 11 erfüllen, wenn sie elektronische Systeme zum Erstellen, Ändern, Verwalten, Archivieren, Abrufen oder Übertragen elektronischer Aufzeichnungen verwenden.
- Validierung: Ein wichtiger Aspekt der Einhaltung von Teil 11 ist die Systemvalidierung. Von Unternehmen wird erwartet, dass sie ihre elektronischen Systeme validieren, um sicherzustellen, dass sie die gesetzlichen Anforderungen erfüllen und wie vorgesehen funktionieren.
- Buchungsprotokolle: Teil 11 erfordert die Implementierung sicherer, computergenerierter, mit Zeitstempel versehener Prüfpfade zur Aufzeichnung von Aktionen, die elektronische Aufzeichnungen erstellen, ändern oder löschen.
- Digitale Signaturen: Elektronische Signaturen müssen mit ihren jeweiligen elektronischen Aufzeichnungen verknüpft und überprüfbar sein.
- Aufbewahrung von Aufzeichnungen: Die Verordnung spezifiziert auch die Anforderungen an die Aufbewahrung elektronischer Aufzeichnungen und die Möglichkeit, diese bei Bedarf in menschenlesbarer Form zu reproduzieren.
Die Einhaltung von CFR 21 Teil 11 ist für Unternehmen in von der FDA regulierten Branchen von entscheidender Bedeutung, um die Integrität und Authentizität elektronischer Aufzeichnungen und Signaturen sicherzustellen. Die Nichteinhaltung von Teil 11 kann zu behördlichen Maßnahmen und Strafen führen. Daher investieren Organisationen, die diesen Vorschriften unterliegen, in Systeme und Prozesse, die die in Teil 11 dargelegten Anforderungen erfüllen, um die Einhaltung sicherzustellen. Es ist zu beachten, dass die spezifische Interpretation und Umsetzung der Anforderungen von Teil 11 von Organisation zu Organisation unterschiedlich sein kann und möglicherweise die Konsultation von Rechts- und Regulierungsexperten erfordert.
Was bedeutet das für Sie und Ihre Organisation?
Wenn Ihr Unternehmen elektronische Systeme zur Verwaltung von FDA-regulierten Daten verwendet, müssen Sie CFR 21 Teil 11 einhalten. Die Verordnung legt spezifische Anforderungen für elektronische Aufzeichnungen und Signaturen fest, einschließlich der Verwendung digitaler Signaturen. Um den Standard einzuhalten, müssen Sie geeignete Kontrollen und Verfahren einrichten sowie genaue Aufzeichnungen erstellen und pflegen. Sie müssen außerdem Schulungen für alle Mitarbeiter anbieten, die bei ihrer Arbeit elektronische Systeme verwenden.
Es gibt eine Reihe von Tools und Services, die Sie bei der Einhaltung von CFR 21 Part 11 unterstützen können. EASEUS bietet beispielsweise Software an, die Part 11-Compliance-Aufgaben wie die Führung von Aufzeichnungen und die Überprüfung von Unterschriften automatisiert. Validation Master Plan bietet Teil 11-Beratungsdienste an, um Unternehmen bei der Bewertung ihrer Compliance-Risiken und der Einführung geeigneter Kontrollen zu unterstützen.
Die Einhaltung von CFR 21 Part 11 ist für jedes Unternehmen, das elektronische Systeme zur Verwaltung von FDA-regulierten Daten nutzt, von entscheidender Bedeutung. Durch die Einführung der richtigen Kontrollen und Verfahren sowie die Investition in Compliance-Tools und -Dienste können Sie sicherstellen, dass Ihr Unternehmen diese wichtige Vorschrift einhält.
Kritische Komponenten von CFR 21 Teil 11:
CFR 21 Teil 11, der elektronische Aufzeichnungen und elektronische Signaturen in von der FDA regulierten Branchen regelt, enthält mehrere kritische Komponenten, die Unternehmen berücksichtigen müssen, um die Einhaltung sicherzustellen. Diese Komponenten tragen dazu bei, die Integrität, Authentizität und Sicherheit elektronischer Aufzeichnungen und Signaturen aufrechtzuerhalten. Hier sind einige der Schlüsselkomponenten von CFR 21 Teil 11:
- Validierung: Vor der Implementierung elektronischer Systeme für regulierte Aktivitäten müssen Organisationen diese validieren, um sicherzustellen, dass sie die beabsichtigten Zwecke genau und zuverlässig erfüllen. Die Validierung umfasst die Überprüfung, ob die Systeme in der Lage sind, Daten auf konforme Weise zu erfassen und zu verwalten.
- Zugriffskontrolle: Teil 11 erfordert strenge Zugriffskontrollen, um den Zugriff auf elektronische Aufzeichnungen und Signaturen nur autorisiertem Personal zu beschränken. Dies beinhaltet die Verwendung von Benutzerauthentifizierungsmechanismen wie Benutzernamen und Passwörtern.
- Datensicherheit: Organisationen müssen Maßnahmen ergreifen, um elektronische Aufzeichnungen vor unbefugtem Zugriff, Änderung oder Löschung zu schützen. Dazu gehören Verschlüsselung, Firewalls und andere Sicherheitsmaßnahmen zum Schutz der Daten.
- Buchungsprotokolle: Elektronische Systeme, die Teil 11 unterliegen, müssen über sichere, computergenerierte, mit Zeitstempel versehene Prüfprotokolle verfügen, die von Benutzern durchgeführte Aktionen aufzeichnen, einschließlich der Erstellung, Änderung und Löschung elektronischer Aufzeichnungen. Diese Prüfpfade sollten zur Überprüfung leicht verfügbar sein.
- Elektronische Signaturen: Teil 11 definiert Anforderungen an elektronische Signaturen, einschließlich Methoden zu deren Erstellung, Speicherung und Überprüfung. Elektronische Signaturen müssen mit ihren jeweiligen elektronischen Aufzeichnungen verknüpft sein und es müssen Kontrollen vorhanden sein, um die unbefugte Verwendung elektronischer Signaturen zu verhindern.
- Aufbewahrung von Aufzeichnungen: Die Verordnung legt die Anforderungen für die Aufbewahrung elektronischer Aufzeichnungen fest, einschließlich der Dauer und der Möglichkeit, Aufzeichnungen bei Bedarf in menschenlesbarer Form zu reproduzieren. Aufzeichnungen müssen so gespeichert werden, dass ihre Integrität und Zugänglichkeit gewährleistet ist.
- Systemdokumentation: Organisationen müssen eine umfassende Dokumentation ihrer elektronischen Systeme pflegen, einschließlich Systemspezifikationen, Verfahren und Validierungsdokumentation. Diese Dokumentation ist für den Nachweis der Konformität von entscheidender Bedeutung.
- Elektronische Kopien von Aufzeichnungen: Teil 11 erlaubt unter bestimmten Bedingungen die Verwendung elektronischer Kopien von Papierunterlagen, sofern die Kopien bestimmte Anforderungen in Bezug auf Genauigkeit, Integrität und Verfügbarkeit erfüllen.
- Änderungen elektronischer Aufzeichnungen: Wenn elektronische Aufzeichnungen ergänzt oder geändert werden, muss es einen klaren und dokumentierten Prozess zur Durchführung dieser Änderungen geben, einschließlich eines Prüfprotokolls der Änderungen und der Gründe dafür.
- Ausbildung und Personalqualifikation: Organisationen müssen sicherstellen, dass das Personal, das elektronische Systeme und elektronische Signaturen verwendet, geschult und qualifiziert ist, um seine Aufgaben effektiv und in Übereinstimmung mit Teil 11 auszuführen.
- Qualitätssicherungsmaßnahmen: Die Einrichtung eines Qualitätssicherungsprogramms ist unerlässlich, um die kontinuierliche Einhaltung der Anforderungen von Teil 11 sicherzustellen. Dazu gehören regelmäßige Überprüfungen, Bewertungen und Audits elektronischer Systeme und Prozesse.
- Elektronische Einreichung bei der FDA: Für Organisationen, die elektronische Aufzeichnungen und Daten an die FDA übermitteln, werden in Teil 11 Anforderungen an das Einreichungsformat und die Verfahren beschrieben, um die Datenintegrität und -sicherheit während des Einreichungsprozesses sicherzustellen.
Diese wichtigen Komponenten von CFR 21 Part 11 sollen Organisationen in von der FDA regulierten Branchen dabei helfen, die Integrität und Authentizität elektronischer Aufzeichnungen und Signaturen aufrechtzuerhalten. Die Einhaltung dieser Anforderungen ist von entscheidender Bedeutung, um regulatorische Probleme und Strafen zu vermeiden und die Qualität und Zuverlässigkeit der Daten im regulierten Umfeld sicherzustellen.
CFR 21 Teil 11 Compliance-Tools und -Dienste:
Die Einhaltung von CFR 21 Teil 11 ist nicht optional – sie ist für alle Unternehmen erforderlich, die elektronische Systeme zur Verwaltung von FDA-regulierten Daten verwenden. Um CFR 21 Part 11 einzuhalten, müssen Sie geeignete Kontrollen und Verfahren einführen sowie genaue Aufzeichnungen erstellen und pflegen. Sie müssen außerdem Schulungen für alle Mitarbeiter anbieten, die bei ihrer Arbeit elektronische Systeme verwenden. Es stehen eine Reihe von CFR 21 Part 11-Compliance-Tools und -Diensten zur Verfügung, die Sie bei diesem Prozess unterstützen.
Das Erreichen und Aufrechterhalten der Einhaltung von CFR 21 Part 11 kann eine komplexe Aufgabe sein, und viele Unternehmen greifen auf verschiedene Tools und Dienste zurück, um die gesetzlichen Anforderungen effektiv zu erfüllen. Diese Tools und Dienste können bei der elektronischen Datensatzverwaltung, der Implementierung elektronischer Signaturen, der Datensicherheit, der Validierung und den allgemeinen Compliance-Bemühungen hilfreich sein. Hier sind einige gängige Tools und Dienste, die Unternehmen zur Einhaltung von CFR 21 Part 11 nutzen können:
- Elektronische Dokumentenmanagementsysteme (EDMS): Die EDMS-Software dient zur Verwaltung elektronischer Aufzeichnungen und gewährleistet deren Sicherheit, Zugänglichkeit und Überprüfbarkeit. EDMS-Systeme umfassen häufig Funktionen wie elektronische Signaturen, Zugriffskontrollen und Prüfprotokolle, die bei der Einhaltung von Teil 11 hilfreich sein können.
- Lösungen für elektronische Signaturen: Software für elektronische Signaturen bietet die Möglichkeit, elektronische Signaturen gemäß den Anforderungen von Teil 11 zu erstellen, zu verwalten und zu überprüfen. Diese Lösungen lassen sich häufig in andere elektronische Datensatzverwaltungssysteme integrieren.
- Audit-Trail-Software: Spezielle Audit-Trail-Software kann Unternehmen dabei helfen, konforme Audit-Trails für elektronische Aufzeichnungen zu erstellen und zu pflegen und alle von autorisierten Benutzern an den Aufzeichnungen vorgenommenen Aktionen zu verfolgen.
- Validierungssoftware: Validierungssoftware unterstützt Unternehmen bei der Validierung ihrer elektronischen Systeme, um sicherzustellen, dass sie die Anforderungen von Teil 11 erfüllen. Es kann dabei helfen, den Validierungsprozess zu dokumentieren und die fortlaufende Einhaltung sicherzustellen.
- Compliance-Management-Software: Diese Tools sollen Unternehmen dabei helfen, Compliance-Bemühungen in verschiedenen Aspekten von Teil 11 zu verwalten und zu verfolgen, einschließlich Dokumentation, Schulung und Audit-Aktivitäten.
- Sichere Datenspeicher- und Backup-Lösungen: Datenspeicher- und Backup-Lösungen mit robusten Sicherheitsfunktionen tragen dazu bei, die Integrität und Verfügbarkeit elektronischer Aufzeichnungen sicherzustellen. Diese Lösungen umfassen häufig Verschlüsselungs- und Redundanzmaßnahmen.
- Schulungs- und Zertifizierungsdienste: Schulungsanbieter und Beratungsunternehmen bieten Teil 11-Compliance-Schulungs- und Zertifizierungsprogramme für Personal an, das an regulierten Aktivitäten beteiligt ist. Schulungen sind von entscheidender Bedeutung, um sicherzustellen, dass Mitarbeiter die Compliance-Anforderungen verstehen und befolgen.
- Regulatorische Beratungsdienste: Regulierungsberater und Experten können bei der Interpretation der Teil-11-Anforderungen behilflich sein, bei Validierungsbemühungen helfen und Compliance-Bewertungen durchführen.
- Elektronische Übermittlungsdienste: Für Organisationen, die elektronische Aufzeichnungen und Daten an die FDA übermitteln müssen, gibt es Dienste, die auf die Formatierung und Gewährleistung der sicheren Übertragung von Daten zur Einhaltung regulatorischer Standards spezialisiert sind.
- Tools zur Dokumentenkontrolle und Workflow-Automatisierung: Diese Tools helfen Unternehmen bei der Verwaltung von Dokumentenkontrollprozessen und stellen sicher, dass elektronische Aufzeichnungen gemäß Teil 11 überprüft, genehmigt und verteilt werden.
- Sichere E-Mail- und Kommunikationslösungen: Organisationen benötigen häufig sichere Kommunikationskanäle für den Austausch elektronischer Aufzeichnungen und Dokumente. Sichere E-Mail- und Messaging-Lösungen können dabei helfen, Verschlüsselungs- und Zugriffskontrollanforderungen zu erfüllen.
- Cloud-Dienste mit Compliance-Funktionen: Einige Cloud-Dienstanbieter bieten spezielle Lösungen zur Einhaltung gesetzlicher Vorschriften an, darunter Teil 11. Diese Dienste umfassen häufig Funktionen zur sicheren Datenspeicherung und Zugriffskontrolle.
Bei der Auswahl von Tools und Diensten für die Einhaltung von CFR 21 Part 11 sollten Unternehmen ihre spezifischen Anforderungen, die Komplexität ihrer elektronischen Aufzeichnungssysteme und ihr Budget berücksichtigen. Darüber hinaus ist es wichtig sicherzustellen, dass alle ausgewählten Tools oder Dienste mit der gesamten Compliance-Strategie des Unternehmens übereinstimmen und die spezifischen regulatorischen Anforderungen erfüllen, die in Teil 11 beschrieben werden. Auch die Beratung durch Regulierungsexperten oder Rechtsberater kann bei der Orientierung in der Compliance-Landschaft hilfreich sein.
Verfügbare Zertifizierungen für die Einhaltung von CFR 21 Teil 11:
Für die Einhaltung von CFR 21 Part 11 stehen zahlreiche Zertifizierungen zur Verfügung. Dazu gehören die Zertifizierung zum Certified CFR 21 Part 11 Professional (CCP) der Regulatory Affairs Professionals Society (RAPS) sowie die Zertifizierung zum Certified Quality Systems Auditor (CQSA) der ASQ.
Das CCP-Zertifizierung richtet sich an Fachleute, die täglich mit der Einhaltung von CFR 21 Teil 11 arbeiten. Die Zertifizierung umfasst Themen wie CFR 21 Part 11-Anforderungen, Aufzeichnungen und Unterschriften, Compliance-Risiken und Risikominderungsstrategien.
Das CQSA-Zertifizierung richtet sich an Qualitätsexperten, die ihr Wissen über die Auditierung von Qualitätssystemen unter Beweis stellen möchten. Die Zertifizierung umfasst Themen wie Qualitätsgrundsätze, Auditplanung, Auditdurchführung und Ergebnisberichterstattung.
Die Einhaltung von CFR 21 Part 11 ist für regulierte Unternehmen, die elektronische Aufzeichnungen und Signaturen verwenden, von entscheidender Bedeutung. Es stehen eine Reihe von Zertifizierungen zur Verfügung, die Ihnen helfen können, Ihr Wissen und Ihr Verständnis der Verordnung nachzuweisen.
Indem Sie in Part-11-Compliance-Tools und -Services investieren und Zertifizierungen anstreben, können Sie sicherstellen, dass Ihr Unternehmen diese wichtige Vorschrift einhält.
Voraussetzungen für CFR 21 Teil 11:
Es gibt 7 kritische Anforderungen für die Einhaltung von CFR 21 Part 11.
1. Datenintegrität
Die Part 11-Regeln der EPA besagen, dass Sie über einen digitalen Prozess und Kontrollen verfügen müssen, um die „Authentizität, Integrität und gegebenenfalls Vertraulichkeit elektronischer Aufzeichnungen“ zu gewährleisten.
Das Hauptziel von Teil 11 besteht darin, sicherzustellen, dass die Daten und Informationen, die Sie während der Entwicklung Ihres Produkts sammeln, korrekt, rückverfolgbar, für Ihren Zweck geeignet und vor Verlust oder Missbrauch geschützt sind. Das Risiko eines Produktausfalls wird reduziert, indem alle Schutzmaßnahmen von Part 11 angewendet werden. Es ist eine kluge Investition.
2. Datenabruf
Die Vorschriften besagen, dass Sie über die Tools verfügen sollten, um Ihre Dokumentation aufzubewahren, „um ihren rechtzeitigen und genauen Abruf während der Aufbewahrungsfrist für Aufzeichnungen zu ermöglichen“. Die Steuerung des Entwicklungsprozesses, sodass Ihre Aufzeichnungen automatisch archiviert, indiziert und bei Bedarf zugänglich sind, hilft Ihnen bei Folgendem:
- Untersuchen und überprüfen Sie Ihr eigenes System gründlich auf Nichtkonformität und Probleme.
- Verfolgung und Rückverfolgung der Grundursachen aller festgestellten Nichtkonformitäten in Ihrem System
- Unterstützung externer Audits – Reagieren Sie schnell auf regulatorische Fragen, um Ihr Unternehmen konform zu halten
3. Validierung
Sie müssen formal beschreiben, wie Ihr System funktionieren soll, und dann Skripte und Testverfahren schreiben, um sicherzustellen, dass es wie vorgesehen funktioniert. Es scheint zwar viel Arbeit zu sein, aber die Validierung Ihres QMS zeigt, dass es seinen Zweck erfüllt, und gibt Ihnen und der Aufsichtsbehörde die Gewissheit, dass Sie in der Lage sind, Waren gemäß den erforderlichen Standards zu liefern.
4. Buchungsprotokolle
Teil 11 verlangt, dass Sie für jedes Qualitätsdokument in Ihrem System über gesicherte, computergenerierte und mit Zeitstempel versehene Audit-Trails einen vollständigen Versionsverlauf zur Verfügung haben, um Datum und Uhrzeit von Vorgangseinträgen und Aktionen, die erstellt oder geändert werden, unabhängig aufzuzeichnen , oder elektronische Aufzeichnungen löschen.
Je mehr Details Sie zu jedem Änderungs- und Freigabeereignis erhalten, desto besser. Indem Sie den Autor, das Datum und die Uhrzeit jeder Änderung und jedes Freigabeereignisses aufzeichnen, haben Sie vollständige Rückverfolgbarkeit und Verantwortlichkeit für alle Entscheidungsaktivitäten während des gesamten Entwicklungsprozesses. Es spart Zeit und Ressourcen als die Verwendung eines papierbasierten Systems bei Prüfungs- und Untersuchungsverfahren.
5. Betriebskontrollen
Eine weitere wichtige Anforderung von Teil 11 ist die Verwendung von Betriebssystemprüfungen zur Durchsetzung geeigneter sequentieller Schritte und Ereignisse.
Die Möglichkeit, automatisierte Workflows zum Einholen von Genehmigungen und Unterschriften zu erstellen, gibt Ihnen mehr Kontrolle über Ihr Team und Verfahren, während Sie den Implementierungsprozess verwalten. Sie können sicherstellen, dass wichtige Papiere gesammelt werden, bevor sie zu bestimmten Zeiten in Ihrem Plan von verschiedenen Personen geprüft werden. Part 11 hilft bei der Schaffung von Ordnung und Klarheit in möglicherweise komplizierten Verfahren und senkt die Gefahr, dass ein Unternehmen kostspielige Fehler macht.
6. Sicherheitskontrollen
Teil 11 legt die Kontrollen fest, die Sie darüber haben, wer Zugriff hat und wie er sich in Ihrem System ändert. Die Regeln umfassen mehrere präzise Kriterien, um Datenverlust und versehentliches Löschen sowie Sicherheitsverletzungen zu verhindern, die Kundenschäden, Geschäftsausfälle und staatliche Bußgelder verursachen können.
7. Elektronische Unterschriften
Teil 11 erwähnt die obligatorische Verwendung von elektronischen Signaturen.
Teil 11 verlangt, dass elektronische Signaturen digital signierte Dokumente mit einem aufgedruckten Namen des Unterzeichners, Datum/Uhrzeit der Signatur und der „Bedeutung“ oder dem Zweck der elektronischen Signatur als Teil eines sich entwickelnden und nicht bearbeitbaren Audit-Trails sein müssen. Dies ist jedoch nicht das Ende der Dinge.
In dem Bemühen, das Maß an rechtlichem Vertrauen zu erreichen, das eine „Wet Signatur“ bietet, hat Part 11 die Authentifizierungsverfahren für digitale Genehmigungen weitaus anspruchsvoller gemacht. Um die Identitätsprüfung und den Schutz vor Betrug zu gewährleisten, benötigen Sie strenge Kontrollen über digitale Dokumente und Prozesse. Es wäre bedeutend einfacher, ein Testergebnis mit Feder und Tinte zu unterschreiben, als derzeit eine elektronische Signatur nach den FDA-Vorschriften zu fälschen.
Visure-Anforderungen ALM-Plattform:
Visure ist eine der vertrauenswürdigsten modernen ALM-Plattformen, die sich auf das Anforderungsmanagement für Organisationen jeder Größe auf der ganzen Welt spezialisiert hat. Es ist ein unverzichtbares Tool für Teams, die komplexe Produkte, Systeme und Software entwickeln, die eine durchgängige Rückverfolgbarkeit von der Konzeption über Tests und Bereitstellung bis hin zum Quellcode sowie die Einhaltung von Standardzertifizierungen erfordern.
Das CFR 21 Part 11 Modul in Visure-Anforderungen ALM-Plattform ist eine Komplettlösung für Unternehmen, die CFR 21 Part 11 einhalten müssen. Das Modul enthält eine CFR 21 Part 11-Checkliste, die Ihnen bei der Beurteilung des Compliance-Status Ihres Unternehmens hilft, und eine CFR 21 Part 11-Vorlage, die zur Erstellung von CFR verwendet werden kann 21 Teil 11-konforme Qualitätsdokumente.
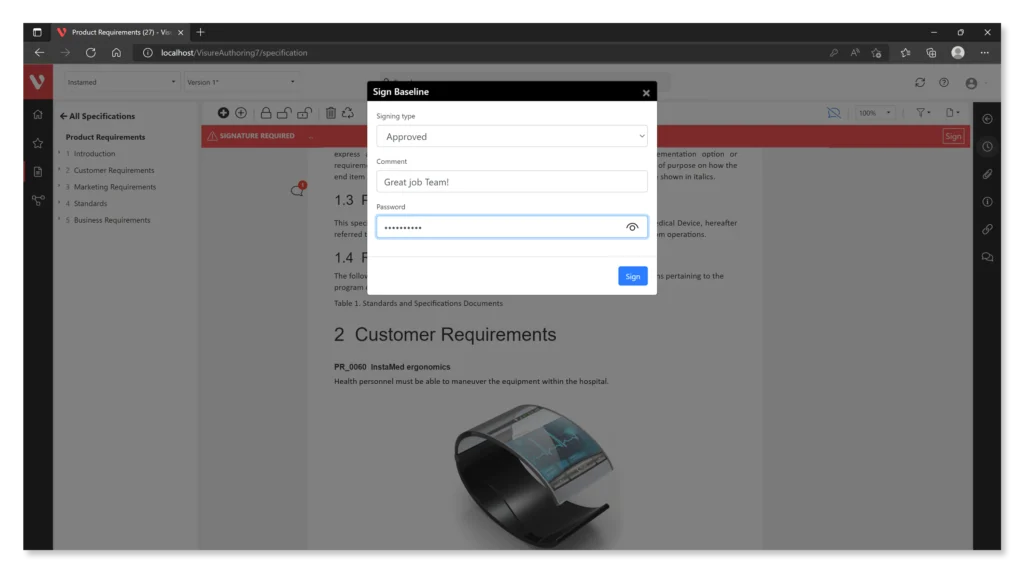
Hier sind einige Funktionen, die Visure bietet:
- Unterstützung für elektronische Signaturen: Die Software sollte die Erstellung und Verwaltung konformer elektronischer Signaturen ermöglichen und sicherstellen, dass diese sicher, überprüfbar und mit den zugehörigen elektronischen Aufzeichnungen verknüpft sind.
- Audit-Trail-Funktionalität: Robuste Audit-Trail-Funktionen ermöglichen es Unternehmen, sichere, zeitgestempelte Aufzeichnungen aller an elektronischen Aufzeichnungen vorgenommenen Aktionen zu führen, einschließlich Erstellung, Änderung und Zugriff.
- Zugangskontrollen: Die Software sollte Zugriffskontrollfunktionen bieten, um den Zugriff auf elektronische Aufzeichnungen einzuschränken und sicherzustellen, dass nur autorisiertes Personal diese anzeigen, bearbeiten oder genehmigen kann.
- Datensicherheit: Starke Datensicherheitsmaßnahmen wie Verschlüsselung und Benutzerauthentifizierung sind unerlässlich, um elektronische Aufzeichnungen vor unbefugtem Zugriff oder Manipulation zu schützen.
- Speicherung und Abruf elektronischer Aufzeichnungen: Das System sollte die sichere Speicherung und den Abruf elektronischer Aufzeichnungen erleichtern und deren Integrität und Verfügbarkeit bei Bedarf gewährleisten.
- Validierungs- und Compliance-Tools: Compliance-Software umfasst häufig Tools, die Unternehmen dabei helfen, ihre Systeme und Prozesse zu validieren, um sicherzustellen, dass sie die Anforderungen von Teil 11 erfüllen. Dazu können Validierungsdokumentationsvorlagen und Workflows gehören.
- Dokumentation und Berichterstattung: Die Software soll bei der Erstellung und Verwaltung der für die Compliance erforderlichen Dokumentation helfen, z. B. Benutzerhandbücher, Standardarbeitsanweisungen (SOPs) und Compliance-Berichte.
- Schulung und Benutzerverwaltung: Mithilfe von Tools zur Verwaltung des Benutzerzugriffs und der Schulungsaufzeichnungen kann sichergestellt werden, dass das Personal entsprechend geschult und autorisiert ist, das System gemäß Teil 11 zu verwenden.
Fazit:
CFR 21 Part 11 ist eine Reihe von Vorschriften der US-amerikanischen Food and Drug Administration (FDA), die für elektronische Aufzeichnungen und Signaturen in der Biowissenschaftsbranche gelten. Die Schlüsselkomponenten von CFR 21 Teil 11 sind Authentifizierung, Integrität, Sicherheit und Aufbewahrung. Um den Standard einzuhalten, müssen Unternehmen über ein System zur Verfolgung von Änderungen an elektronischen Aufzeichnungen, zur Authentifizierung von Benutzeraktionen und zur Pflege von Prüfprotokollen verfügen. Die Visure Requirements ALM-Plattform unterstützt Unternehmen bei der Erfüllung dieser Anforderungen, indem sie eine sichere Plattform für die Verwaltung von Anforderungen und Änderungsmanagementprozessen bereitstellt. Fordern Sie eine an Kostenlose 30-Tage-Testversion Besuchen Sie noch heute die Visure Requirements ALM Platform und erfahren Sie, wie unsere Software Ihnen bei der Einhaltung von Vorschriften helfen kann.